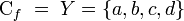Tomado De: Office.monografias.com
¿QUE ES UNA BASE DE DATOS?
Una base de datos es una herramienta para recopilar y organizar información. En las bases de datos, se puede almacenar información sobre personas, productos, pedidos, o cualquier otra cosa. Muchas bases de datos empiezan siendo una lista en un programa de procesamiento de texto o en una hoja de cálculo. A medida que crece la lista, empiezan a aparecer repeticiones e inconsistencias en los datos. Cada vez resulta más complicado comprender los datos presentados en la lista y existen pocos métodos para buscar o recuperar subconjuntos de datos para revisarlos.
¿QUE ES MICROSOFT ACCESS?
Es un programa, utilizado en los sistemas operativos Microsoft Windows, para la gestión de bases de datos creado y modificado por Microsoft y orientado a ser usado en entornos personal o en pequeñas organizaciones. Es un componente de la suite Microsoft Office. Permite crear ficheros de bases de datos relacionales que pueden ser fácilmente gestionadas por una interfaz gráfica sencilla. Dentro de un sistema de información, entraría dentro de la categoría de gestión, y no en la de ofimática, como podría pensarse. Este programa permite manipular los datos en forma de tablas (formadas por filas y columnas), crear relaciones entre tablas, consultas, formularios para introducir datos e informes para presentar la información. ¿QUE ES UNA BASE DE DATOS ACCESS?
una base de datos de Access almacena sus tablas en un solo archivo, junto con otros objetos, como formularios, informes, macros y módulos. Con Access ,se puede:
* Agregar más datos a una base de datos, por ejemplo, un elemento nuevo en un inventario.
· * Modificar datos existentes en la base de datos, por ejemplo, cambiar la ubicación de un elemento.
· *Eliminar información, por ejemplo, si se ha vendido o retirado un artículo.
* Organizar y ver los datos de distintas formas.
*Compartir los datos con otros usuarios mediante informes, mensajes de correo electrónico, una intranet o Internet.
¿CUALES SON LOS COMPONENTES DE UNA BASE DE DATOS ACCESS?
Los componentes de una base de datos de Access son:
Una tabla de una base de datos es similar en apariencia a una hoja de cálculo, en cuanto a que los datos se almacenan en filas y columnas. Como consecuencia, normalmente es bastante fácil importar una hoja de cálculo en una tabla de una base de datos. La principal diferencia entre almacenar los datos en una hoja de cálculo y hacerlo en una base de datos es la forma de organizarse los datos.
Para lograr la máxima flexibilidad para una base de datos, la información tiene que estar organizada en tablas, para que no haya redundancias. Por ejemplo, si se almacena información sobre empleados, cada empleado se insertará una sola vez en una tabla que se configurará para contener únicamente datos de los empleados. Los datos sobre productos se almacenarán en su propia tabla, y los datos sobre sucursales también tendrán su tabla aparte. Este proceso se conoce como normalización.
Cada fila de una tabla se denomina registro. En los registros es donde se almacena cada información individual. Cada registro consta de campos (al menos uno). Los campos corresponden a las columnas de la tabla. Por ejemplo, puede trabajar con una tabla denominada "Empleados", en la que cada registro (fila) contiene información sobre un empleado distinto y cada campo (columna) contiene un tipo de información diferente, como el nombre, los apellidos, la dirección, o similares. Los campos se deben configurar con un determinado tipo de datos, ya sea texto, fecha, hora, numérico, o cualquier otro tipo.
Otra forma de describir registros y campos es imaginando un catálogo de fichas tradicional de una biblioteca. Cada ficha del armario corresponde a un registro de la base de datos. Cada información contenida en una ficha (autor, título, etc.) corresponde a un campo de la base de datos.
Los formularios se conocen a veces como "pantallas de entrada de datos". Son las interfaces que se utilizan para trabajar con los datos y, a menudo, contienen botones de comando que ejecutan diversos comandos. Se puede crear una base de datos sin usar formularios, editando los datos de las hojas de las tablas. No obstante, casi todos los usuarios de bases de datos prefieren usar formularios para ver, escribir y editar datos en las tablas.
Los formularios proporcionan un formato fácil de utilizar para trabajar con los datos. Además, se les puede agregar elementos funcionales, como botones de comando. Puede programar los botones para determinar qué datos aparecen en el formulario, abrir otros formularios o informes, o realizar otras tareas diversas. Por ejemplo, podría crear un formulario denominado "Formulario de cliente" para trabajar con datos de clientes. El formulario de cliente podría tener un botón para abrir un formulario de pedido en el que se pudiese escribir un pedido nuevo del cliente.
Los formularios también permiten controlar la manera en que otros usuarios interactúan con los datos de la base de datos. Por ejemplo, puede crear un formulario que muestre únicamente ciertos campos y que permita la ejecución de determinadas operaciones solamente. Así, se favorece la protección de los datos y se facilita la entrada correcta de datos.
Los informes sirven para resumir y presentar los datos de las tablas. Normalmente, un informe responde a una pregunta específica, como "¿Cuánto dinero se ha facturado por cliente este año?" o "¿En qué ciudades están nuestros clientes?" Cada informe se puede diseñar para presentar la información de la mejor manera posible.
Un informe se puede ejecutar en cualquier momento y siempre reflejará los datos actualizados de la base de datos. Los informes suelen tener un formato que permita imprimirlos, pero también se pueden consultar en la pantalla, exportar a otro programa o enviar por correo electrónico.
Las consultas son las que verdaderamente hacen el trabajo en una base de datos. Pueden realizar numerosas funciones diferentes. Su función más común es recuperar datos específicos de las tablas. Los datos que desea ver suelen estar distribuidos por varias tablas y, gracias a las consultas, puede verlos en una sola hoja de datos. Además, puesto que normalmente no desea ver todos los registros a la vez, las consultas le permiten agregar criterios para "filtrar" los datos hasta obtener solo los registros que desee. Las consultas a menudo sirven de origen de registros para formularios e informes.
Algunas consultas son "actualizables", lo que significa que es posible editar los datos de las tablas base mediante la hoja de datos de la consulta. Si trabaja con una consulta actualizable, recuerde que los cambios se producen también en las tablas, no solo en la hoja de datos de la consulta.
Hay dos tipos básicos de consultas: las de selección y las de acción. Una consulta de selección simplemente recupera los datos y hace que estén disponibles para su uso. Los resultados de la consulta pueden verse en la pantalla, imprimirse o copiarse al portapapeles. O se pueden utilizar como origen de registros para un formulario o un informe.
Una consulta de acción, como su nombre indica, realiza una tarea con los datos. Las consultas de acción pueden servir para crear tablas nuevas, agregar datos a tablas existentes, actualizar datos o eliminar datos.
Las macros en Access se pueden considerar como un lenguaje de programación simplificado, que se puede utilizar para aumentar la funcionalidad de la base de datos. Por ejemplo, puede adjuntar una macro a un botón de comando en un formulario, de modo que la macro se ejecute cuando se haga clic en el botón. Las macros contienen acciones que realizan tareas, como abrir un informe, ejecutar una consulta o cerrar la base de datos. Casi todas las operaciones de bases de datos que normalmente se realizan manualmente se pueden automatizar mediante macros, ahorrando así mucho tiempo.
Los módulos, como las macros, son objetos que sirven para aumentar la funcionalidad de la base de datos. Mientras que las macros en Access se crean seleccionando acciones de una lista, los módulos se escriben en el lenguaje de programación. Un módulo es una colección de declaraciones, instrucciones y procedimientos que se almacenan conjuntamente como una unidad. Un módulo puede ser de clase o estándar. Los módulos de clase se adjuntan a formularios o informes, y normalmente contienen procedimientos específicos del formulario o el informe al que se adjuntan. Los módulos estándar contienen procedimientos generales que no están asociados a ningún otro objeto. Los módulos estándar se enumeran en módulos en el panel de exploración, pero los módulos de clase no.
¿CUALES SON LOS ASPECTOS QUE DEBEN TENERSE EN CUENTA PARA DISEÑAR UNA BASE DE DATOS EN ACCESS?
El primer paso para crear una base de datos, es planificar el tipo de información que se quiere almacenar en la misma, teniendo en cuenta dos aspectos: la información disponible y la información que necesitamos.
La planificación de la estructura de la base de datos, en particular de las tablas, es vital para la gestión efectiva de la misma. El diseño de la estructura de una tabla consiste en una descripción de cada uno de los campos que componen el registro y los valores o datos que contendrá cada uno de esos campos.
Los campos son los distintos tipos de datos que componen la tabla, por ejemplo: nombre, apellido, domicilio. La definición de un campo requiere: el nombre del campo, el tipo de campo, el ancho del campo, etc.
Los registros constituyen la información que va contenida en los campos de la tabla, por ejemplo: el nombre del paciente, el apellido del paciente y la dirección de este. Generalmente los diferente tipos de campos que su pueden almacenar son los siguientes: Texto (caracteres), Numérico (números), Fecha / Hora, Lógico (informaciones lógicas si/no, verdadero/falso, etc., imágenes.
En resumen, el principal aspecto a tener en cuenta durante el diseño de una tabla es determinar claramente los campos necesarios, definirlos en forma adecuada con un nombre especificando su tipo y su longitud.
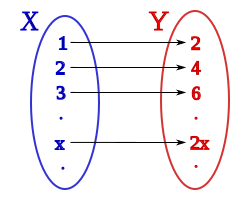

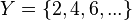
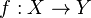


 con un (y sólo un)
con un (y sólo un)  se denota
se denota  , en lugar de
, en lugar de 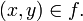
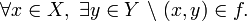

 o
o  . A los elementos del dominio se les llama habitualmente argumento de la función.
. A los elementos del dominio se les llama habitualmente argumento de la función.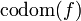 o
o  o
o  o
o 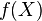 .
.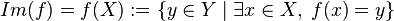
 , tiene como dominio, codominio e imagen a todos los
, tiene como dominio, codominio e imagen a todos los 

 tal que
tal que  , en cambio, si bien su dominio y codominio son iguales a
, en cambio, si bien su dominio y codominio son iguales a  , sólo tendrá como imagen los valores comprendidos entre 0 y +
, sólo tendrá como imagen los valores comprendidos entre 0 y +